
Informe Técnico 10 – Dispensação de Medicamentos Referência, Genéricos e Similares Intercambiáveis
Desde que a RDC Nº58 DE 10 DE OUTUBRO DE 2014 foi publicada surgiram muitas dúvidas quanto à dispensação dos medicamentos Similares Intercambiáveis com os medicamentos Referência.
Montei este Informe Técnico para ajudar a esclarecer as dúvidas no momento da dispensação dos medicamentos Referência, Genéricos e Similares Intercambiáveis (descritos na RDC Nº58/2014)
Informe Técnico 10 – Dispensação de Medicamentos Referência, Genéricos e Similares Intercambiáveis
1- DEFINIÇÕES
PRODUTO FARMACÊUTICO INTERCAMBIÁVEL → Equivalente terapêutico de um medicamento de referência, comprovados, essencialmente, os mesmos efeitos de eficácia e segurança. (Lei nº 9787/99)
EQUIVALENTES FARMACÊUTICOS → São medicamentos que contêm o mesmo fármaco, isto é, mesmo sal ou éster da mesma molécula terapeuticamente ativa, na mesma quantidade e forma farmacêutica, podendo ou não conter excipientes idênticos. Devem cumprir com as mesmas especificações atualizadas da Farmacopéia Brasileira e, na ausência destas, com as de outros códigos autorizados pela legislação vigente ou, ainda, com outros padrões aplicáveis de qualidade, relacionados à identidade, dosagem, pureza, potência, uniformidade de conteúdo, tempo de desintegração e velocidade de dissolução, quando for o caso (RDC 17/2007).
BIODISPONIBILIDADE RELATIVA → Quociente da quantidade e velocidade de princípio ativo que chega à circulação sistêmica a partir da administração extravascular de um preparado e a quantidade e velocidade de princípio ativo que chega à circulação sistêmica a partir da administração extravascular de um produto de referência que contenha o mesmo princípio ativo (RDC 17/2007).
MEDICAMENTOS BIOEQUIVALENTES → São equivalentes farmacêuticos que, ao serem administrados na mesma dose molar, nas mesmas condições experimentais, não apresentam diferenças estatisticamente significativas em relação à biodisponibilidade.
2- O QUE DIZ A LEGISLAÇÃO
2.1 SOBRE O REGISTRO DOS MEDICAMENTOS SIMILARES
Em 2003 a RDC Nº133 DE 29 DE MAIO DE 2003, determinou que todos os medicamentos similares fossem submetidos aos testes de equivalência farmacêutica e biodisponibilidade relativa para comprovação científica de que produzem o mesmo efeito, na mesma dosagem e no mesmo tempo gasto pelo medicamento de referência. A RDC Nº134, DE 29 DE MAIO DE 2003 estabeleceu os critérios para adequação dos Medicamentos similares já presentes no mercado.
Em 2007 a RDC Nº133/2003 foi revogada pela RDC Nº17, DE 02 DE MARÇO DE 2007 que aprova o regulamento técnico para registro de medicamentos similares.
Devido ao prazo dado em 2003 para a adequação dos medicamentos similares às regras de equivalência farmacêutica, hoje em 2016 todos os similares devem ser equivalentes aos medicamentos de referência.
2.2 SOBRE A DISPENSAÇÃO DOS MEDICAMENTOS
A Resolução RDC Nº 51/2007 acrescentou ao texto da Resolução Nº 17 o capítulo “Critérios para prescrição e dispensação de medicamentos similares”, estabelecendo que medicamentos similares poderiam ser dispensados quando prescritos pelo nome produtos da marca ou pela DCB (item 2.1) » Mais tarde, porém, o este item foi modificado pela RDC Nº 53/2007 que altera os itens 1.2. e 2.1., da RDC Nº51/2007, ambos do item VI, do Anexo, da Resolução RDC Nº 17, de 2 de março de 2007,
Dessa forma as farmácias e drogarias privadas devem seguir o disposto no item 2.3 da Resolução RDC – ANVISA nº 16/07 (abaixo), NÃO SENDO PERMITIDA A DISPENSAÇÃO DO MEDICAMENTO SIMILAR EM CASOS DE PRESCRIÇÃO COM A DCB OU DCI.
2.3. Nos casos de prescrição com a Denominação Comum Brasileira (DCB) ou a Denominação Comum Internacional (DCI), somente será permitida a dispensação do medicamento de referência ou de genérico correspondentes;
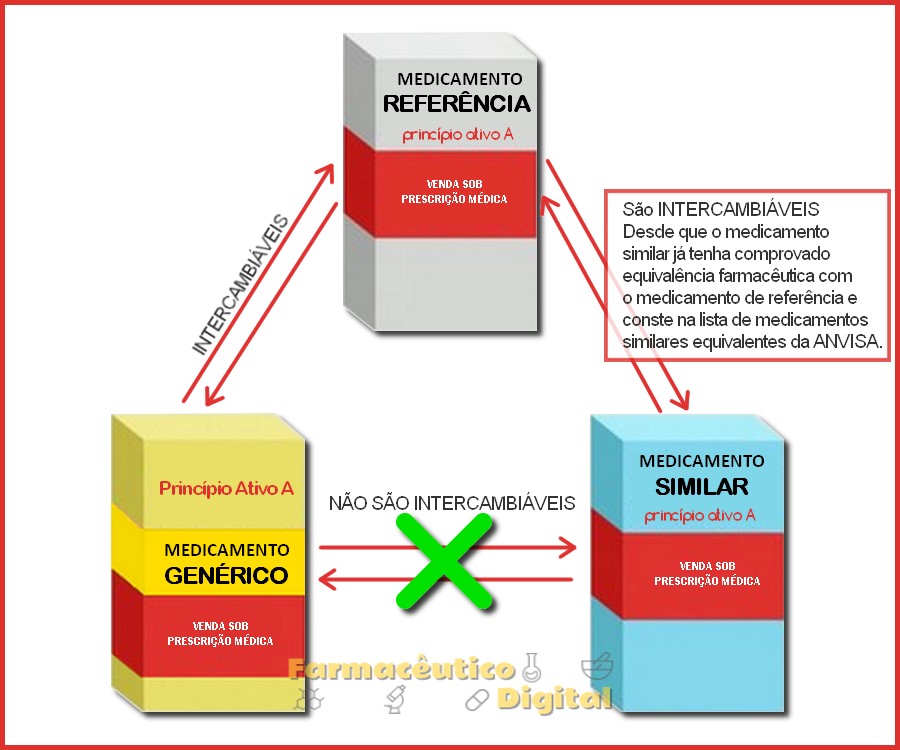
» Este item justifica o fato dos Similares não serem Intercambiáveis com os Genéricos.
Então, de acordo com as legislações citadas as Regras para a Dispensação são:
NAS FARMÁCIAS PÚBLICAS:
- A prescrição deve ser feita obrigatoriamente pelo nome genérico (Denominação Comum Brasileira ou, na sua falta, Denominação Comum Internacional);
- Na dispensação será observada a disponibilidade de produtos.
NAS FARMÁCIAS E DROGARIAS PRIVADAS:
- A prescrição pode ser feita tanto pelo nome genérico quanto pela marca comercial;
- Quando na receita constar o nome genérico poderá ser dispensado o medicamento de referência ou o genérico correspondente (conforme listas atualizadas periodicamente pela Anvisa);
- O medicamento similar poderá ser dispensado quando constar na receita o nome da marca comercial do produto similar;
- Caso o prescritor não aceite a substituição do medicamento de referência pelo genérico, ele deverá fazê-lo por escrito, de próprio punho e para cada medicamento prescrito.
OBSERVAÇÃO IMPORTANTE: De acordo com o inciso XI do artigo 10 da Lei n 6437/1977, é considerado infração sanitária “aviar receita em desacordo com prescrição médica ou determinação expressa de lei e normas regulamentares”, com pena de advertência, interdição, cancelamento da licença e/ ou multa. Também o Código de Ética da Profissão Farmacêutica proíbe ao farmacêutico (artigo 13, início XV) “expor, dispensar ou permitir que seja dispensado medicamento em contrariedade à legislação vigente”.
Em 2014 foi publicada a RDC Nº 58, DE 13 DE OUTUBRO DE 2014, que definiu as medidas a serem adotadas junto à ANVISA pelos titulares de registro de medicamentos para a intercambialidade de medicamentos similares com o medicamento de referência, ficou determinada a disponibilização no site da ANVISA a relação dos medicamentos similares indicando os medicamentos de referência com os quais são intercambiáveis para fins de consulta pela população por profissionais de saúde ou qualquer outro interessado.
Ainda de acordo com a RDC Nº58/2014 todos os medicamentos similares intercambiáveis constantes da lista também, terão na bula do medicamento a informação a respeito da intercambialidade, conforme determina a RDC 58/2014. Tal informação será apresentada por meio da frase: MEDICAMENTO SIMILAR EQUIVALENTE AO MEDICAMENTO DE REFERÊNCIA. A referida informação deve ser incluída na seção da bula “Identificação do Medicamento”, logo abaixo da Denominação Comum Brasileira (DCB) do(s) princípio(s) ativo(s) do medicamento, respeitando o modelo já existente de bula descrito no Anexo I da RDC 47/09.
Para Relembrar:
O QUE É INTERCAMBIALIDADE?
Intercambialidade indica a possibilidade de substituição de um medicamento prescrito pelo profissional da saúde por um medicamento genérico ou similar equivalente, desde que este conste na lista de medicamentos similares intercambiáveis disponibilizada pela ANVISA.
3- COMO PROCEDER AO DISPENSAR OS MEDICAMENTOS DE REFERÊNCIA, GENÉRICOS E SIMILARES
Ao atender uma prescrição com um medicamento de Referência o farmacêutico pode dispensar o Genérico ou o medicamento Similar Equivalente que esteja na lista da ANVISA desde que não haja restrições indicadas por escrito na receita feitas pelo profissional prescritor.
A RDC Nº 58/2014 regulamentou a intercambialidade entre o medicamento similar e referência, ou seja, os requisitos necessários para que o similar possa substituir o medicamento de referência.
Essa norma não se aplica aos medicamentos isentos de prescrição.
» Acesse aqui ▼a Lista de Medicamentos Similares Intercambiáveis▼
»LINK ANVISA DA LISTA DE MEDICAMENTOS INTERCAMBIÁVEIS
Veja na imagem abaixo como pode ser feita a dispensação dos medicamentos em uma farmácia e/ou drogaria privada.
Aqui você pode fazer o DOWNLOAD do Informe Técnico 10 – Dispensação de Medicamentos Referência, Genéricos e Similares Intercambiáveis para imprimir no seu trabalho e orientar todos que trabalham na dispensação de medicamentos.
4- REFERÊNCIAS BIBLIOGRÁFICAS
Legislação
- LEI Nº 9.787, DE 10 DE FEVEREIRO DE 1999
- RDC Nº 16, DE 2 DE MARÇO DE 2007
- RDC Nº 17, DE 2 DE MARÇO DE 2007
- RDC Nº 51, DE 15 DE AGOSTO DE 2007 – Link DOU
- RDC Nº 53, DE 30 DE AGOSTO DE 2007
- RDC Nº 58, DE 10 DE OUTUBRO DE 2014
- Link para Pesquisa das resoluções → http://portal2.saude.gov.br/saudelegis/leg_norma_pesq_consulta.cfm?limpar=pesquisa
Outras Referências
- Resoluções Medicamentos – ANVISA
- Apresentação ANVISA- Medicamentos Similares
- Seção ANVISA – Medicamentos Similares
- Boletim Informativo ANVISA – N50 Dez 2004
- Prescrição e Dispensação de Medicamentos Genéricos e Similares – ANVISA
- Intercambialidade entre medicamentos de referência, genéricos e similares CRF-PR
- http://portal.crfsp.org.br/comunicacao/noticias/2458-intercambialidade.html
- http://www.ache.com.br/arquivos/FOLHETO_INTERCAMBIALIDADE_PDV.pdf
- http://www.novaquimicafarma.com.br/Arquivos/RDC%2058_2014_Intercambialidade_entre_medicamento_similar_e_referencia_RIR3PY.pdf
- https://farmaceuticoonline.wordpress.com/2011/02/15/intercambialidade-de-medicamentos/
- http://www.ufrgs.br/pnaum/sobre-medicamentos – Imagens
OBSERVAÇÃO: Alguns links relacionados a ANVISA podem não funcionar corretamente devido a mudança da estrutura do portal da ANVISA.





Referente aos psicotrópicos lista de similares intercambiáveis, quando receitado o nome genérico é possível trocar pelo similar que consta na lista?
Olá Camila,
Pela legislação vigente o genérico só pode ser trocado pelo de referência.
Em qual das situações a abaixo o generico podera see dispensado